Voer een woord of zin in in een taal naar keuze 👆
Taal:
Vertaling en analyse van woorden door kunstmatige intelligentie ChatGPT
Op deze pagina kunt u een gedetailleerde analyse krijgen van een woord of zin, geproduceerd met behulp van de beste kunstmatige intelligentietechnologie tot nu toe:
- hoe het woord wordt gebruikt
- gebruiksfrequentie
- het wordt vaker gebruikt in mondelinge of schriftelijke toespraken
- opties voor woordvertaling
- Gebruiksvoorbeelden (meerdere zinnen met vertaling)
- etymologie
Wat (wie) is Макрокинетика - definitie
макрокинетика
ж.
Раздел химической кинетики, изучающий влияние процессов переноса вещества и тепла на скорость химических реакций (обычно в промышленных условиях).
Раздел химической кинетики, изучающий влияние процессов переноса вещества и тепла на скорость химических реакций (обычно в промышленных условиях).
Макрокинетика
кинетика макроскопических процессов, описывающая протекание химических превращений в их взаимосвязи с физическими процессами переноса вещества (массы), тепла и электрического заряда. Термин "М." стал употребляться в начале 40-х годов 20 века (в частности, в работах советского физико-химика Д. А. Франк-Каменецкого) и охватывает все явления, возникающие в результате влияния процессов переноса вещества и тепла на скорость химических превращения. Кинетика химическая рассматривает скорость только самой химической реакции. В реальных же условиях химические превращение часто сопровождается процессами массо- и теплопередачи, зависящими от гидродинамических условий движения газа, жидкости или твёрдых частиц, причём скорости этих последних процессов нередко лимитируют общую скорость процесса. На основе М. построен ряд практически важных теорий: гетерогенного катализа на пористых катализаторах, химических реакторов, горения, растворения и выщелачивания, электрохимических процессов на электродах (и, в частности, процесса генерации тока в топливном элементе), ферментеров микробиологической промышленности и других. С конца 50-х годов при решении проблем М. применяется математическое Моделирование.
Согласно этому методу, сложный химико-технологический процесс расчленяется на химические и физические составляющие, проводится раздельное их изучение, после чего их взаимное влияние определяется математическими методами с использованием ЭВМ. Это вызвано невозможностью в большинстве случаев воспроизвести в лаборатории во всех особенностях реальный процесс, сопровождающийся переносом вещества и тепла, как это имеет место в промышленных условиях. Попытки решать задачи М. на основе подобия теории (См. Подобия теория) и физического моделирования оказались безуспешными из-за несовместимости условий подобия химических и физических составляющих процесса. Для решения проблем М. должны быть известны закономерности собственно химического превращения, не искажённые влиянием процессов переноса, и законы массо- и теплопередачи. Закономерности химического превращения выражаются в виде кинетических уравнений, отражающих зависимость скорости химической реакции от состава реакционной смеси, температуры, давления, свойств катализатора (для каталитических процессов) и др.
Практические задачи М. так же многообразны, как и химико-технологические процессы. Однако значительная часть вопросов рассматривается в следующих разделах: диффузионная кинетика, изучающая влияние массопереноса на скорость гетерогенных химических реакций в условиях, когда перенос тепла можно не учитывать; теория гетерогенных экзотермических и эндотермических процессов, протекающих в условиях, когда необходимо одновременно учитывать перенос тепла и вещества; теория горения, изучающая роль переноса вещества и тепла в протекании гомогенных экзотермических реакций; макрокинетика процессов растворения; макрокинетика электрохимических процессов (см. Электрохимия); химическая гидродинамика - исследование гидродинамических свойств потока газов или жидкостей путём измерения скорости хорошо изученных химических процессов.
Диффузионная кинетика. Всякий гетерогенный химический процесс, протекающий на границах раздела фаз (гетерогенные каталитические реакции, адсорбция, электрохимические реакции на поверхности электрода, химическое растворение и другие), состоит из стадий переноса реагирующих веществ к поверхности, на которой происходит реакция, собственно химические реакции и отвода продуктов реакции от реакционной поверхности. Суммарная скорость процесса определяется скоростями отд. стадий. В том случае, когда медленной стадией процесса является перенос реагирующих веществ, считают, что процесс протекает в диффузионной области и описывается диффузионной кинетикой. Диффузионная кинетика имеет большое значение для многих процессов химической технологии, особенно для гетерогенных каталитических процессов. Промышленные Катализаторы, представляют собой пористые зёрна с развитой внутренней активной поверхностью, площадь которой равна десяткам и сотням м2 на 1 г. Каталитический процесс состоит из следующих этапов: переноса реагирующих веществ из ядра потока через пограничный слой к внешней поверхности зерна, диффузии реагирующих веществ внутрь зерна через поры, химические превращения на активной поверхности катализатора и переноса продуктов реакции в обратном направлении. В зависимости от соотношения скоростей этих стадий различают области внешней диффузии, внутренней диффузии и кинетическую область.
В области внешней диффузии скорость реакции определяется переносом вещества к наружной поверхности катализатора (или твёрдого тела, реагирующего с газом). Скорость массопередачи к единице наружной поверхности пропорциональна разности концентраций в ядре газового потока сг и у внешней поверхности катализатора сп, и её можно выразить в виде b(сг - сп), где b - коэффициент массопередачи, описывающий осреднённый перенос вещества через пограничный слой и зависящий от гидродинамики потока.
В области внутренней диффузии концентрации сг и сп близки, то есть перенос вещества к наружной поверхности не снижает общей скорости, а концентрация реагирующих веществ в центре зерна катализатора сц близка к нулю для необратимых реакций или к равновесной для обратимых. Пористая структура зёрен катализатора очень сложна и может быть описана только статистически. Это затрудняет определение эффективного коэффициента диффузии Dэф. Если поры настолько велики, что молекулы диффундирующего вещества сталкиваются между собой чаще, чем со стенками пор, то эффективный коэффициент диффузии определяется на основе молекулярного DM: Dэф = DMeП, где e - пористость зерна, а П - множитель, учитывающий строение пор. В узких порах молекулы сталкиваются со стенками чаще, чем между собой; диффузия в этом случае называется кнудсеновской. В области внутренней диффузии реакция практически происходит только на некоторой части внутренней поверхности. Основной характеристикой доступности внутренней поверхности катализатора является степень её использования h. Она равна отношению скорости реакции в зерне к скорости реакции, рассчитанной в предположении, что на всей поверхности катализатора концентрация реагирующего вещества равна его концентрации на внешней поверхности зерна. Для необратимой реакции первого порядка h = 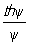 , где
, где 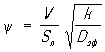 , (V - объём зерна, Sп - наружная поверхность зерна, k - константа скорости реакции первого порядка, отнесённая к единице объёма). Наблюдаемая форма кинетического уравнения в области внутренней диффузии отличается от истинной; наблюдаемый порядок реакции по компоненту, диффузия которого определяет процесс, становится средним между действительным и первым порядком, а по всем остальным компонентам - уменьшается в два раза; наблюдаемая энергия активации становится также в два раза меньше истинной. Коэффициенты b, Dэф и параметры e и П определяются экспериментально.
, (V - объём зерна, Sп - наружная поверхность зерна, k - константа скорости реакции первого порядка, отнесённая к единице объёма). Наблюдаемая форма кинетического уравнения в области внутренней диффузии отличается от истинной; наблюдаемый порядок реакции по компоненту, диффузия которого определяет процесс, становится средним между действительным и первым порядком, а по всем остальным компонентам - уменьшается в два раза; наблюдаемая энергия активации становится также в два раза меньше истинной. Коэффициенты b, Dэф и параметры e и П определяются экспериментально.
Если процессы переноса достаточно быстры по сравнению со скоростями химических стадий и концентрации реагирующих веществ в ядре потока, у наружной поверхности и в центре зерна практически не различаются, то скорости переноса вещества не влияют на общую скорость реакции. Эту область называют кинетической.
Теория гетерогенных экзотермических процессов. Если гетерогенная реакция обладает значительным тепловым эффектом, то температуры в центре зерна Тз, у наружной поверхности зерна Тп и в ядре газового потока Тг различаются между собой. При эндотермических процессах Тг > Тп > Тз, а при экзотермических Тг < Тп < Тз. Эндотермическая реакция всегда протекает в устойчивом режиме. В случае экзотермической реакции возможно несколько устойчивых и неустойчивых стационарных режимов. Переход от одного теплового режима к другому осуществляется скачкообразно и сопровождается критическими явлениями воспламенения и затухания. В частности, воспламенение твёрдого тела связано со скачкообразным переходом реакции из кинетической области в область внешней диффузии. Температура поверхности превосходит температуру газа в ядре потока на величину адиабатического разогрева реакционной смеси. Обратный переход также осуществляется скачкообразно и отвечает критическим условиям затухания. В области переходной между внешней диффузией и кинетической существуют неустойчивые стационарные режимы, которые не реализуются без принудительной стабилизации специальной системой автоматического управления. Наличие критических явлений определяется параметром адиабатического разогрева реакционной смеси при полном превращении [Dqад = (Тп - Тг) E / RT2г, где Е - энергия активации, R - газовая постоянная] и отношением константы скорости реакции, рассчитанной для единичной наружной поверхности зерна kп, к коэффициенту массопередачи b. Если Dqад > 4 и кп /b > 0,135, то критические явления возможны. В зерне катализатора критические явления могут наблюдаться, если параметр Ψτ= Dqад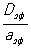 > 4,5 (aэф - эффективная температуропроводность) иΨτ2 < 0,08. Значения Ψτ> 4,5 для промышленных каталитических процессов редко встречаются и достигаются только для сильно экзотермических реакций при высоких начальных концентрациях реагирующего вещества.
> 4,5 (aэф - эффективная температуропроводность) иΨτ2 < 0,08. Значения Ψτ> 4,5 для промышленных каталитических процессов редко встречаются и достигаются только для сильно экзотермических реакций при высоких начальных концентрациях реагирующего вещества.
Горение - химическая реакция в условиях интенсивного самоускорения, вызванного накоплением в реагирующей смеси тепла или активных продуктов цепной реакции с разветвленными цепями. Анализ процесса горения проводится также на основе данных химической кинетики, теплопроводности и диффузии реагирующих веществ. Характерной особенностью горения является способность к пространственному распространению вследствие передачи тепла или активных частиц (см. Горение).
Макрокинетика процессов растворения рассматривает один из важнейших процессов химической технологии. Химическое растворение является сложным гетерогенным процессом, состоящим из стадий переноса растворителя к поверхности, на которой происходит реакция, собственно химической реакции и отвода продуктов реакции от реакционной поверхности. Суммарная скорость растворения определяется скоростями отдельных стадий, и в зависимости от соотношения скоростей возможны кинетическая или диффузионные области, как и при диффузионной кинетике.
Лит.: Франк-Каменецкий Д. А., Диффузия и теплопередача в химической кинетике, 2 изд., М., 1967; Макрокинетика процессов в пористых средах, М., 1971; Егерев В. К., Диффузионная кинетика в неподвижных средах, М., 1970: Вильямс Ф. А., Теория горения, перевод с английского, М., 1971; Левеншпиль О., Инженерное оформление химических процессов, перевод с английского, М., 1969.
М. Г. Слинько.
МАКРОКИНЕТИКА
(макроскопическая кинетика) , изучает кинетические закономерности химических реакций, которые сопровождаются одновременными протекающими в системе процессами диффузии, теплопереноса и др. Знание макрокинетических закономерностей в реальных условиях протекания особенно важно для горения, гетерогенного катализа, электрохимических процессов и др.

